
ESTUDIO DEL PROCESO DE EXTRACCIÓN DE ANTOCIANINAS A PARTIR DE
FRAMBUESA (Rubus idaeus L). LAMBAYEQUE – 2018
___________________________________________________________________________
STUDY OF THE PROCESS OF EXTRACTION OF ANTHOCYANINS FROM RASPBERRY
(Rubus idaeus L.) LAMBAYEQUE – 2018
Saavedra Alarcón Leslie Shiomara1
Símpalo López Walter Bernardo2
La frambuesa tiene una elevada concentración de antocianinas, convirtiéndose en una materia prima apropiada para la extracción de colorante natural. Así el objetivo de este proyecto de investigación fue evaluar la extracción de antocianinas a partir de frambuesa teniendo como variables dependientes la temperatura, tiempo y tipo solventes.
Se empleó un proceso de extracción solido líquido en un sistema de destilación a reflujo. El contenido de antocianinas se determinó por espectrofotometría empleando la técnica de pH diferencial. Las mejores condiciones de extracción que permiten obtener mayor concentración de antocianinas es solvente metanol, temperatura de 70°C y tiempo de 45 minutos.
Palabras claves: Frambuesa (Rubus idaeus L.), antocianina, pH diferencial.
The raspberry has a high concentration of anthocyanins, becoming an appropriate raw material for the extraction of natural dye. Thus the objective of this research project was to evaluate the extraction of anthocyanins from raspberry having as dependent variables the temperature, time and solvent type.
A liquid solid extraction process was used in a reflux distillation system. The content of anthocyanins was determined by spectrophotometry using the differential pH technique. The best extraction conditions that allow obtaining a higher concentration of anthocyanins is solvent methanol, temperature of 70 ° C and time of 45 minutes.
Keywords: Raspberry, anthocyanin, differential pH.
__________________________________________________________________________________
1. Introducción
Al consumir un alimento, el color es el primer atributo sensorial a ser observado, de este modo, para satisfacer las expectativas de los consumidores, que a menudo asocian el color, sabor y aroma (Henry, 1996). Las industrias alimenticias, gradualmente, están buscando nuevas formas de mejorar y estandarizar el color de los alimentos procesados, que constantemente se ven afectados durante la producción en consecuencia la exposición de los alimentos a cambios de temperatura, pH, luz y largos períodos de almacenamiento. (Henry, 1996)
Con la prohibición del empleo de numerosos colorantes artificiales, se observa una nueva tendencia en la sustitución por colorantes naturales, de modo que el consumo y la importancia de éstos, en los últimos años (Cunha, 2008; Moritz, 2005). Más allá de conferir al producto una apariencia natural, aumentando la receptividad por los consumidores, los colorantes naturales se han utilizado durante años sin pruebas de maleficios a la salud. (Gomes, 2012)
En este contexto, las antocianinas que están compuestas por el mayor conjunto de pigmentos solubles en agua del reino vegetal según (Bridle & Timberlake, 1997), han sido estudiadas por ser agentes de coloración natural en los alimentos. Las antocianinas se encuentran ampliamente distribuidas en la naturaleza, presentes en flores, frutos, vegetales, tallos y raíces. (Mallacrida & Motta, 2006)
La importancia y la eficacia del empleo de antocianinas como colorante natural se debe al hecho de proporcionar un extraordinario color rojo brillante en los alimentos ácidos, como refrescos, mermeladas y dulces, pudiendo ser utilizadas como sustituto vegetariano para el carmín de cochinilla en productos con bajo pH. (Downhan & Collins, 2000)
Sin embargo, las antocianinas presentan características inconvenientes, como el deterioro ejercido en el transcurso de la extracción vegetal, en el proceso y en el almacenamiento de alimentos como consecuencia de las variaciones de pH, temperatura, influencia del oxígeno, enzimas y de la interferencia de la luz (Lopes et al., 2007; Gomes, 2012). Por lo tanto, es esencial establecer criterios de extracción de este pigmento, de manera que las antocianinas proporcionan el menor posible de cambios en sus propiedades, para posteriormente se utilizan. (Lopes, 2002)
Entre los frutos, la frambuesa (Rubus idaeus L.), perteneciente a la familia rosáceas, gana destaque debido a su coloración roja intensa, su sabor dulce una acentuada acidez. Y consiste en una fruta rica en vitaminas, como ácido ascórbico, tiaminas, riboflavina, niacina, vitamina B6 y A, minerales, como el potasio, calcio, magnesio, fósforo, hierro y otros, y también en compuestos fenólicos, particularmente flavonoides, entre los cuales, las más importantes son las antocianinas (Wang y Lin, 2000), siendo predominante la presencia de cianidina-3-glicosido, cianidina-3glicosilrutinosideo y cianidina-3-rutinosideo en frambuesa (Wang, Chen y Wang, 2009). Sin embargo, el alta percibida de la frambuesa, debido a su alta actividad respiratoria y la gran área de exposición, factores que facilitan la deshidratación del fruto y el ataque de microorganismos como los hongos. (Antunes, Filho y Souza, 2003; Raseira et al., 2004)
Para los fines de la investigación se utilizó frambuesa (Rubus idaeus L.) traídas de Trujillo, donde actualmente se está fomentando su cultivo con fines de exportación.
La matriz de experimento se realizó con el software DESIGN EXPERT 7.0, teniendo como variables independientes la temperatura, tiempo y tipo de solvente (Tabla 1). Se aplicó un diseño D-Optimo, el tipo de diseño fue superficie respuesta y el modelo fue cuadrático.
Tabla 1
Matriz de experimentos
Run |
A:Tiempo |
B:Tempertura |
C:Solvente |
|
min |
°C |
|
1 |
30 |
40 |
Etanol |
2 |
30 |
55 |
Etanol |
3 |
30 |
70 |
Etanol |
4 |
30 |
40 |
Metanol |
5 |
30 |
55 |
Metanol |
6 |
30 |
70 |
Metanol |
7 |
45 |
40 |
Etanol |
8 |
45 |
55 |
Etanol |
9 |
45 |
47.5 |
Metanol |
10 |
45 |
70 |
Metanol |
11 |
60 |
40 |
Etanol |
12 |
60 |
70 |
Etanol |
13 |
60 |
40 |
Metanol |
14 |
60 |
70 |
Metanol |
Fuente: Elaboración propia.
El proceso de extracción de antocianinas es el siguiente:
Recepción: Se recepcionó en bandejas de tecnopor, y se evitó que los frutos sean golpeados. Selección: Se seleccionó aquellos frutos que no presentaron daños en su tejido. Congelado: Se congeló a temperatura de -15 °C, en bolsa de polietileno. Pesado: Se pesaron 5gr. De frambuesa en una balanza analítica. Triturado: Las frambuesas fueron trituradas con la ayuda de un mortero. Extracción: Se procedió a extraer las antocianinas por un proceso de extracción solido-liquido controlando los variables tiempo, temperatura y tipo de solvente, según los diferentes tratamientos. La extracción solido-liquido se realizó por un sistema de destilación a reflujo que estuvo conformado por un matraz doble boca fondo redondo, cocina eléctrica de laboratorio, barra magnética y un condensador de bolas. El volumen de extracción fue de 50 ml., preparando una solución de metanol: agua destilada (10:40 v/v) y etanol: agua destilada (10:40 v/v). Filtración: Para eliminar los sólidos insolubles del extracto de antocianinas se procedió a filtrar, utilizando papel filtro whatman N°1, el equipo de filtración al vacío estaba formando por embudo buchner, matraz kitosato de 500 ml y una bomba de vacío. Cuantificación: Se cuantifico el contenido de antocianinas mediante el método del pH diferencial.

Figura 1. Diagrama de flujo del proceso de extracción de antocianinas.
Fuente: Elaboración propia
El procedimiento para la cuantificación de antocianinas es el siguientes:
Se utilizó dos sistemas de tampón para disolver los extractos de antocianinas: Ácido clorhídrico/cloruro de potasio de pH 1 (0.025M) y ácido acético/acetato de sodio de pH 4.5 (0.4M). A 0.3ml de muestra se añade 2.7ml de la correspondiente Solución Tampón y se medió la absorbancia a 510 y 700 nm. Se calculó la absorbancia total a partir de:
A = (A510 nm − A700 nm)pH 1 − (A510 nm − A700 nm)pH 4.5
La concentración del pigmento manométrico en el extracto se expresó en cianidina 3-glucosido.
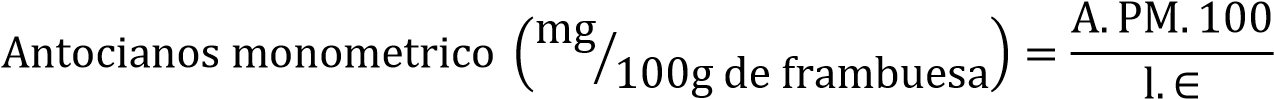
Donde A es la absorbancia total. E1 PM el peso molecular (449.2 g/gmol), la ∈ es la absortividad molar (26900cm-1mol-1), ambas de la cianidina 3-glucido y 1 es la longitud de paso de luz de la celda (1 cm) (Kuskoski, 2005)
En la tabla 2 se presentan los resultados obtenidos para los diferentes tratamientos experimentales.
Tabla 2
Resultados de las variables dependientes según matriz experimental.
|
|
Factor 1 |
Factor 2 |
Factor 3 |
Respuesta 1 |
Std |
Run |
A:Tiempo |
B:Tempertura |
C:Solvente |
Rendimiento |
|
|
min |
°C |
|
mg de cianidina 3- glucosido/100g de frambuesa |
2 |
1 |
30 |
40 |
Etanol |
0,39465031 |
14 |
2 |
30 |
55 |
Etanol |
0,45977596 |
5 |
3 |
30 |
70 |
Etanol |
0,43138786 |
11 |
4 |
30 |
40 |
Metanol |
0,56887534 |
9 |
5 |
30 |
55 |
Metanol |
0,50096654 |
13 |
6 |
30 |
70 |
Metanol |
0,55328971 |
12 |
7 |
45 |
40 |
Etanol |
0,55050657 |
6 |
8 |
45 |
55 |
Etanol |
0,56386568 |
10 |
9 |
45 |
47,5 |
Metanol |
0,54939331 |
1 |
10 |
45 |
70 |
Metanol |
0,49373036 |
3 |
11 |
60 |
40 |
Etanol |
0,3963202 |
4 |
12 |
60 |
70 |
Etanol |
0,53269442 |
7 |
13 |
60 |
40 |
Metanol |
0,60282974 |
8 |
14 |
60 |
70 |
Metanol |
0,55607286 |
Fuente: Elaboración propia
En la tabla 3 se presenta el análisis de varianza para el rendimiento de antocianinas expresado en mg de cianidina 3-glucosido/100g de frambuesa, como se puede observar no hay variables significativas, indicando que estas no son estadísticamente significativas en el rendimiento, al tener p-valores mayores a 0.05
Tabla 3
Análisis de varianza para la variable dependiente rendimiento de antocianinas.
|
Suma de |
Grados de |
Promedio |
Valor |
p-valor |
Source |
cuadrados 0,03298414 |
libertad 8 |
cuadrado |
F |
Prob > F |
Model |
0,00412302 |
0,82566218 |
0.6153 |
||
A-Tiempo |
0,00303577 |
1 |
0,00303577 |
0,60793404 |
0.4708 |
B-Temperatura |
9,862E-06 |
1 |
9,862E-06 |
0,00197494 |
0.9663 |
C-Solvente |
0,01523973 |
1 |
0,01523973 |
3,05185821 |
0.1411 |
AB |
0,00058594 |
1 |
0,00058594 |
0,11733832 |
0.7459 |
AC |
0,00015334 |
1 |
0,00015334 |
0,03070712 |
0.8678 |
BC |
0,00640084 |
1 |
0,00640084 |
1,28181173 |
0.3089 |
A^2 |
0,00493671 |
1 |
0,00493671 |
0,98861046 |
0.3657 |
B^2 |
8,698E-06 |
1 |
8,698E-06 |
0,00174182 |
0.9683 |
Residual |
0,02496795 |
5 |
0,00499359 |
|
|
Cor Total |
0,05795209 |
13 |
|
|
|
R-Squared |
0,86916227 |
|
|
|
|
Fuente: Design Expert 7.0
En la figura 2 se presenta el grafico de contorno y la superficie de respuesta para el rendimiento, cuando el solvente es etanol. De la Figura 3 se puede observar que se tiene mayor rendimiento a una temperatura de 70oC y un tiempo de 50 minutos.
Gráfico de contorno y superficie de respuesta para el rendimiento con solvente etanol
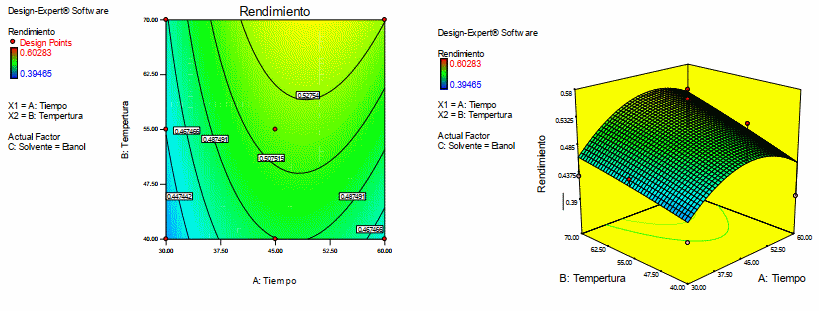
Figura 2: Gráfico de superficie de respuesta y contorno para la variable dependiente rendimiento de antocianina teniendo como solvente etanol
Fuente: Design Expert 7.0
Gráfico de interacción con solvente etanol
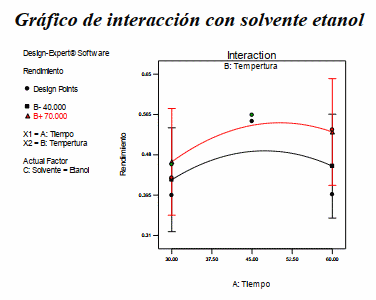
Figura 3: Gráfico de interacción para la variable dependiente rendimiento de antocianina teniendo como solvente etanol
Fuente: Design Expert 7.0
En la figura 4 se presenta el grafico de contorno y la superficie de respuesta para el rendimiento, cuando el solvente es metanol. De la Figura 5 se puede observar que se tiene mayor rendimiento a una temperatura de 40oC y un tiempo de 50 minutos.
Gráfico de contorno y superficie de respuesta para el rendimiento con solvente metanol
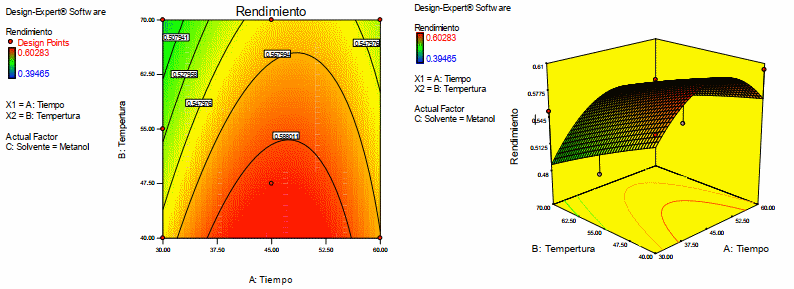
Figura 4. Gráfico de superficie de respuesta y contorno para la variable dependiente rendimiento de antocianina teniendo como solvente metanol. Fuente: Design Expert 7.0
Gráfico de interacción con solvente metanol
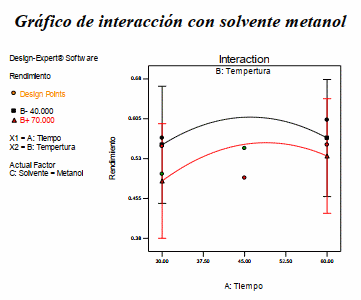
Figura 5. Gráfico de interacción para la variable dependiente rendimiento de antocianina teniendo como solvente metanol.
Fuente: Design Expert 7.0
En la figura 6, se presenta el grafico de probabilidad normal, en el cual la línea recta representa los residuales cuando se ajustan a distribución normal, como se puede observar los residuales de los tratamientos experimentales se ajusta a una distribución normal para la variable dependiente rendimiento de antocianinas.
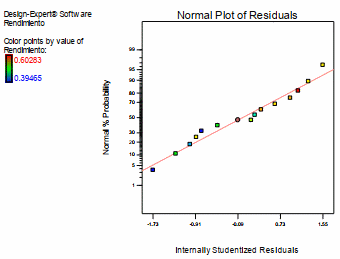
Figura 6. Gráfico de distribución normal de los residuales para la variable dependiente rendimiento de antocianina.
Fuente: Design Expert 7.0
A mayor temperatura aumenta el rendimiento de antocianinas, este resultado está de acuerdo con (Cacace & Mazza, 2003) que extrajeron compuestos fenólicos y antocianinas a partir de grosella negra con agua sulfurada y observaron que la extracción de antocianinas era afectada por el volumen de solvente y la temperatura. Este hecho puede estar relacionado con el efecto de la temperatura, en su estudio observaron que al aumentar la temperatura de 6 a 30ºC, hubo un aumento en el rendimiento y reducción significativa en el tiempo de extracción de antocianinas de grosellas negras, con el empleo de solventes Alcohol y agua sulfurada, sin embargo, la aplicación de temperaturas de extracción de 40 y 70ºC ocasionó rendimientos inferiores en consecuencia a la descomposición de las antocianinas.
Mayor rendimiento se obtuvo para metanol, resultados similar obtuvo (Montelongo, Gonzales, & Lobo, 2010) quienes desarrollaron un proceso de extracción por solvente de compuestos metanólicos ricos en antioxidantes a partir de la cáscara de plátano y optimizaron el número de etapas (1 a 3), temperatura (25 a 50ºC) y tiempo de extracción (0 - 120 min). Las antocianinas se encuentran en las células próximas a la cara externa de las plantas y en el proceso de extracción se retiran fácilmente por disolventes orgánicos. Es común el empleo de soluciones acidificadas como alcohol, acetona, agua y mezclas de acetona / alcohol / agua han sido usadas para extraer antocianinas (Ju & Howard, 2013) .
Finalmente, se puede observar que existen diferentes estudios relacionados con el
tema, sin embargo, faltan muchos aspectos por aclarar como el contenido de antocianinas en fruto, su técnica de extracción y de estabilización química en las condiciones de Perú. La Frambuesa tiene potencial para ser un recurso natural importante en la elaboración de colorantes naturales, por esta razón es de gran importancia la realización de estudios sobre la extracción y estabilización química de las antocianinas que pueda contener con el fin de obtener productos de valor agregado con aplicaciones tanto en el sector de los alimentos como en el cosmético.
Las condiciones que permiten obtener mayor concentración de antocianinas es solvente metanol, temperatura de 70°C y tiempo de 45 minutos.
El colorante natural extraído de las antocianinas puede sustituir el colorante sintético, mediante otros métodos de conservación.
Antunes, L., Filho, J., & Souza, C. (2003). Conservação pós-colheita de frutos de amoreira-preta. Pesquisa Agropecuária Brasileira. Brasília, 38(3).
Bridle, P., & Timberlake, C. (1997). Anthocyanins as natural food colours selected aspects. Food
Chemistry, 28(1-2), 103-109. Recuperado el 10 de Mayo de 2018, de https://eurekamag.com/research/008/166/008166637.php
Cacace, J., & Mazza, G. (2003). Mass transfer process during extraction of phenolic compounds from milled berries. J.Food Eng., 59, 379-389.
Cunha, F. (2008). Estudo da Extração Mecânica de Bixina das Sementes de Urucum em Leito de Jorro. Tesis, Universidad Federal de Uberlândia, Facultad de Ingeniería Química, Universidad Federal de Uberlândia, Uberlândia. Recuperado el 28 de Mayo de 2018, de https://repositorio.ufu.br/bitstream/123456789/15111/1/Fabiano%20G.pdf
Downhan, A., & Collins, P. (2000). Colouring our foods in the last and next millennium. International Journal of Food Science and Technology, 35, 5-22.
Gomes, L. (2012). Inclusão de carotenoides de pimentão vermelho em ciclodextrinas e avaliação da sua estabilidade, visando aplicação em alimentos. Dissertação (Mestre em Ciências Aplicadas), Faculdade de Farmácia, Universidade Federal Fluminense, Niterói, 108.
Recuperado el 20 de Mayo de 2018, de
https://app.uff.br/riuff/bitstream/1/3313/1/Gomes%2C%20Lidiane%20Martins%20Men des%20%5BDisserta%C3%A7%C3%A3o%2C%202012%5D.pdf
Henry, B. (1996). Natural food colours. En G. Henry, & J. Houghton, Natural food coloursNatural Food Colorants (2 ed., págs. 40-79).
Ju, Z., & Howard, L. (2013). . Effects of Solvent and Temperature on Pressurized Liquid Extraction of Anthocyanins and Total Phenolics from Dried Red Grape Skin. Journal of Agricultural and Food Chemistry, 21(18), 5207-5213.
Kuskoski, E. (2005). Aplicaciones de diversos metodos quimicos para determinar actividad antioxidante en pulpa de frutos. Ciencia y tecnología alimentaria., 25(4), 726-732.
Obtenido de http://www.scielo.br/scielo.php?script=sci_arttext&pid=S010120612005000400016
Lopes, T. (2002). Adsorção de antocianinas do repolho roxo em argilas. Dissertação. (Mestrado em Engenharia Química), Universidade Federal de Santa Catarina, Florianópolis-SC.
Lopes, T., Xavier, M., Quadri, M., & Quadri, M. (2007). Antocianinas: Uma breve revisão das características estruturais e da estabilidade. R. Bras. Agrociência, Pelotas, 13(3), 291297.
Montelongo, R., Gonzales, M., & Lobo, M. (2010). The effect of extraction temperature, time and number of steps on the antioxidant capacity of methanolic banana peel extracts. Separation and Purification. Technology, 347-355.
Wang, S., & Lin, H. (2000). Antioxidant activity in fruits and leaves of blackberry, raspberry, and strawberry varies with cultivar and developmental stage. Journal of Agricultural and Food Chemistry, 48(2), 140-146.
Wang, S., Chen, T., & Wang, C. (2009). The influence of light and maturity on fruit quality and flavonoid content of red raspberry. Food Chemistry, 112, 676-684.
1 1Adscrita a la Escuela Académica Profesional de Ingeniería Agroindustrial y Comercio Exterior____________________________ . Ingeniería,
Arquitectura y Urbanismo. Universidad Señor de Sipán., Pimentel. Lambayeque. Perú, email: SHIOMARA@crece.uss.edu.pe
2 Adscrito a la Escuela Académica Profesional de Ingeniería Agroindustrial y Comercio Exterior. Ingeniería, Arquitectura y Urbanismo. Universidad Señor de Sipán., Pimentel. Lambayeque. Perú, email:
wsimpalo@crece.uss.edu.pe