
RIOS,
E. S., DE CARVALHO J. A., ALVARADO, C. A. Modelos matemáticos de
la temperatura de llama adiabática para productos de combustión
de síntesis de gas. Rev. Ingeniería: Ciencia, Tecnología e
Innovación. Julio - diciembre 2020. Vol. 7 / Nº 2, pp. 205-2017 -
ISSN: 2313-1926
MODELOS
MATEMÁTICOS DE LA TEMPERATURA DE LLAMA ADIABÁTICA PARA PRODUCTOS DE
COMBUSTIÓN DE SÍNTESIS DE GAS
MATHEMATICAL
MODELS OF THE ADIABATIC FLAME TEMPERATURE FOR SYNTHESIS GAS
COMBUSTION PRODUCTS
 Edwin
Santiago Rios Escalante
Edwin
Santiago Rios Escalante
 João
Andrade de Carvalho JR
João
Andrade de Carvalho JR
 Carlos
Alexis Alvarado Silva
Carlos
Alexis Alvarado Silva

Fecha
de recepción : 15 de Octubre del 2020
Fecha
de aprobación : 30 de Noviembre del 2020
DOI :
https://doi.org/
Resumen
La
situación energética y medioambiental global hace que los sistemas
de generación de energía basados en energías renovables sean
cada vez más importantes. Estos sistemas tienen una doble ventaja,
ya que permiten la diversificación energética y reducen la
dependencia del petróleo, al tiempo que se reducen las emisiones
globales de CO2.
La biomasa es una de las fuentes de energía más prometedoras en los
países desarrollados y emergentes, pero aún no experimenta el
desarrollo esperado. El sistema de gasificación de biomasa es un
sistema con gran potencial, ya que permite la generación de energía
tanto térmica como eléctrica, a través de tecnologías de bajo
costo, como gasificadores de lecho fijo (potencia media-baja), o
reactores de lecho. fluidizado con tecnología más exigente y más
capacidad de generación. Transformar la biomasa en un combustible
gaseoso, utilizable en motores de combustión interna convencionales
o turbinas de gas como combustible, la biomasa requiere varios pasos
por procesos termoquímicos compuestos de reacciones endotérmicas
(secado, volatilización y reducción) y exotérmicas (oxidación y
carbón volátil). En este trabajo se calcula la temperatura de la
llama adiabática con el objetivo de obtener la materia prima que
produce una mayor energía térmica, utilizando para nuestro caso
cinco tipos de biomasa como son: Eucalyptus Globulus o Blue
Eucalyptus, Cane Bagasse (subproducto de la industria azucarera),
Cascara de Arroz, Sequoia Gigante (residual) y Álamo Negro, con
mayor énfasis en este último por considerarse una buena alternativa
por su aparentemente rápido crecimiento (aprox. 2 años). De esta
forma, una comparación de la energía térmica producida por los
cinco tipos de biomasa utilizados.
Palabras
Clave:
Temperatura de llama adiabática, biomasa, gasificación.
Abstract
The
global energy and environmental situation makes energy generation
systems based on renewable energies increasingly important. These
systems have a double advantage, as they allow energy diversification
and reduce dependence on oil, while global emissions of CO2
are reduced. Biomass is one of the most promising sources of energy
in developed and emerging countries, but it still does not undergo
the expected development. The biomass gasification system is a system
with great potential, since it allows the generation of thermal as
well as electrical energy, through low cost technologies, such as
fixed bed gasifiers (medium - low power), or bed reactors fluidized
with more demanding technology and more generation capacity.
Transforming biomass into a gaseous fuel, usable in conventional
internal combustion engines or gas turbines as fuel, biomass requires
several passages through thermochemical processes composed of
endothermic (drying, volatilization and reduction) and exothermic
reactions (oxidation and volatile coal). In this work, the adiabatic
flame temperature is calculated with the objective of obtaining the
raw material that produces a higher thermal energy, using for our
case five types of biomass such as: Eucalyptus Globulus or Blue
Eucalyptus, Cane Bagasse (by-product of the industry sugar bowl),
Rice Husk, Redwood Big (residual) and Black Poplar, with greater
emphasis on the latter because it is considered a good alternative
due to its apparently rapid growth (approx. 2 years). In this way, a
comparison of the thermal energy produced by the five types of
biomass used
Keywords:
Adiabatic
flame temperature, biomass, gasification
Introducción
La administración de residuos
sólidos urbanos (RSU) es uno de los problemas más importantes,
especialmente para el desarrollo de los países. La cantidad de
sólidos generados por las actividades humanas ha ido aumentando
drásticamente y estas características dependen del lugar y el
estilo de vida de las personas. En general, se pueden encontrar cinco
categorías aceptables para el control de desechos, a saber: 1)
prevención, 2) reutilización y reciclaje, 3) desechos orgánicos,
4) incineración, 5) basura. Últimamente, la incineración se
considera uno de los procedimientos más eficaces para los residuos
(Tchobanoglous & Kreith, 2002).
La incineración no solo reduce el volumen de residuos sólidos,
también convierte este tipo de residuos en una forma de energía.
Este esquema se conoce
popularmente como residuos para conversión de energía (WTE). Sin
embargo, dados los problemas ambientales promedio relacionados con la
incineración, es necesario instalar equipos sofisticados para
limpiar los gases de escape. Dependiendo del país, estos pueden ser
grandes y costosos (Morris & Waldheim, 1998).
La conversión termoquímica
(combustión, gasificación y pirólisis) es la principal tecnología
que se puede utilizar ampliamente para generar energía sin
contaminantes ambientales (Gasification Word Database 2007 (Current Industry Status Report), 2007).
La gasificación es uno de los procesos de conversión termoquímica
en los que se pueden producir combustibles limpios. La gasificación
es compatible con nuevas aplicaciones en el área de conversión de
biomasa (cuando se usa con biomasa, es carbono natural); el carbono
se convierte en combustible líquido útil, sobre todo se logra un
mayor rendimiento para el medio ambiente con la captura de CO2
y eliminación de azufre, y la posibilidad de mejorar sustancialmente
la eficiencia cuando se incluye en centrales de ciclo combinado con
Gasificador (IGCC).
La
gasificación es un proceso termoquímico en el que el contenido de
carbono de la materia prima se convierte en gas de síntesis que
comprende hidrógeno (H2)
y monóxido de carbono (CO). La materia prima típica utilizada en
los procesos de gasificación es el carbón y la biomasa, así como
los residuos peligrosos. La producción de gas de síntesis mediante
gasificación es un proceso complejo que depende de varios factores,
incluida la composición de la materia prima, las condiciones de
presión y temperatura del gasificador y el tipo y cantidad de
oxidante y moderador (CO2
el vapor) (Abuadala, I, & G, 2010).
El proceso
de gasificación utiliza la combustión parcial de la materia prima,
controlando cuidadosamente la cantidad de oxidante. La cantidad de
oxidante también controla la temperatura del proceso de
gasificación, que es el parámetro más importante del gasificador,
según informó Walawender (Walawender, Hoveland, & Fan, 1985).
El proceso
de gasificación es una serie de procesos exotérmicos y
endotérmicos. Por lo tanto, se requiere una cantidad considerable de
energía térmica para sostener el proceso, esta energía es
suministrada por una fuente de calor externa o por la combustión
parcial de la materia prima. Durante la combustión parcial, una
cantidad considerable (~ 25%) de materia prima se quema mediante el
proceso de gasificación, lo que proporciona energía para disminuir
la humedad. Esta cantidad depende principalmente de la composición y
el poder calorífico de la materia prima.
La
eficiencia del proceso de gasificación es la principal preocupación
que decide la viabilidad de diseñar un sistema. La eficiencia se
mide en términos de la potencia calorífica del gas de síntesis
producido con respecto a la potencia calorífica de la materia
prima (Nakamura, y otros, 2008) (Sharma, 2010).
El
único elemento limpio presente en el gas producido por gasificación
es H2,
porque la combustión de H2
produce agua. Por otro lado, el CO y el CH4
se utilizan para producir CO2
por combustión, lo que genera problemas ambientales (Pathak, y otros, 2008).
El gas metano se puede convertir en H2
y CO2
a alta temperatura, pero el problema sigue siendo el CO porque su
combustión da lugar a CO2.
Por lo tanto, la reacción de desplazamiento se usa ampliamente para
convertir CO en H2
(Chen & Jiang, 2008).
El resto del CO2
se separa típicamente del sistema anterior mediante el uso de
productos de gasificación en la generación de energía, es decir,
el ciclo Brayton de turbinas de gas o celdas de combustible. De esta
manera, se produce combustible limpio en términos de gas H2.
Por tanto, el H2
producido por el sistema de gasificación depende de la producción
directa de gas H2
a partir de la materia prima y de la producción indirecta que
convierte el CO mediante una reacción de desplazamiento. En este
sentido, el CO contribuye a la formación de combustible limpio y
aumenta el valor de la planta generadora de energía (CGE).
El modelo
de equilibrio termodinámico aproximado se usa ampliamente para
evaluar la eficiencia del sistema de gasificación en términos de la
composición y eficiencia del gas producto. Zanail (Zainal, Ali, Lean, & Seetharamu, 2001)
desarrolló un modelo de equilibrio termodinámico para predecir la
gasificación en el gasificador
Downdraft. Se investigó el estudio de los parámetros en términos
del contenido de humedad inicial en la materia prima y la temperatura
en la zona de gasificación. Finalmente, se calculó la potencia
calorífica del gas de síntesis producido y mostró una tendencia a
disminuir con el aumento del contenido de humedad en la materia
prima. Jarungthammachote (Jarungthammachote & Dutta, 2007)
desarrolla un tipo de equilibrio similar al de Zainal
(Zainal, Ali, Lean, & Seetharamu, 2001)
para calcular la composición del gas de síntesis producido por los
residuos sólidos urbanos utilizando un gasificador
de Downdraft.
A
continuación, se muestra si se han realizado supuestos para este
análisis:
La materia
prima en seco y sin cenizas.
El flujo
en estado estacionario se considera dentro del gasificador.
La energía
potencial y cinética son insignificantes.
Las
mejores especies se consideran en los gases producto, a saber: CO,
CO2,
H2,
CH4
y N2.
No se
considera la contribución de la ceniza a la ecuación energética.
Se
considera el comportamiento del gas ideal para toda la fase gaseosa.
Se
considera que el gasificador funciona de forma isotérmica y la
caída de presión en el gasificador es depreciable.
No hay
pérdidas de calor, es decir, una condición de funcionamiento
adiabática.
Para cada
etapa del gasificador, todos los gases producto se consideran a la
misma temperatura
Temperatura
de llama adiabática
Llamamos
temperatura de llama adiabática a la temperatura más alta que se
puede obtener para los productos de combustión, alcanzándose la
misma, si no hay pérdida de energía fuera del sistema durante el
proceso de combustión.
Para
calcular la temperatura de la llama adiabática, necesitamos conocer
el calor específico a presión constante, Cp,
de la mezcla de gases que constituye los productos de combustión. Si
este calor específico correspondiera a una sola sustancia y el rango
de temperatura entre TL
y TF
fuera constante para todos, sería suficiente hacer:
 -
-

Como el
calor específico varía mucho con la temperatura, ya que es una
mezcla de gases, el lado derecho de la ecuación anterior debe
reemplazarse por una integral:

Materiales y Métodos
Los cálculos se realizan para
cinco tipos diferentes de biomasa como son: bagazo de caña de
azúcar, cascarilla de arroz, eucalipto, secuoya gigante, álamo
negro, con el fin de obtener la mayor energía térmica. La Tabla 1
muestra si el último análisis se realizó sin cenizas secas para
los cinco tipos de biomasa. El porcentaje en parte del carbono
presente en la biomasa en comparación con los demás elementos.
Tabla 1.
Análisis elemental de materia
prima sobre una base seca sin cenizas
Materia
Prima
|
C
%
|
H
%
|
O
%
|
N
%
|
S
%
|
Bagazo
de caña
|
44.80
|
5.35
|
39.55
|
5.35
|
0.01
|
Cascara
de arroz
|
38.5
|
5.7
|
39.8
|
0.5
|
0.00
|
Eucalipto
Globulus
|
48.18
|
5.92
|
44.18
|
0.39
|
0.01
|
Secoya
gigante
|
53.5
|
5.9
|
40.3
|
0.10
|
0.00
|
Alamo
Negro
|
49.2
|
6.3
|
44.13
|
0.33
|
0.02
|
Fuente:
(Prabir, 2010)
|
El
porcentaje en orden de cada materia prima se utiliza para calcular la
fórmula empírica considerando carbono, hidrógeno, oxígeno y
nitrógeno. La Tabla 2 muestra si la fórmula empírica
correspondiente a cada biomasa. Estas fórmulas se calculan sobre una
base molar por normalización a un solo átomo de carbono. Los
valores caloríficos superior (PCS) e inferior (PCI) se muestran en
la Tabla 3, y se calculan utilizando la siguiente relación (Prabir, 2010).
Muchos
países de Europa definen la eficiencia de los sistemas térmicos en
términos de PCI. De esta forma, una eficiencia expresada de esta
manera es mayor que la expresada en términos de PCS como suele
ocurrir en varios países entre ellos Estados Unidos y Canadá.


Dónde:
PCI:
menor potencia térmica
PCS:
Potencia térmica superior
H:
porcentaje de hidrógeno
M:
porcentaje de humedad
hg:
Calor latente del vapor (2260 KJ / Kg)
Tabla 2.
Fórmula
Empírica de cada Biomasa
Matéria
prima
|
Formula
Empírica
|
Bagazo
de cana
|

|
Cascara
de arroz
|

|
Eucalipto
Globulus
|

|
Secoya
gigante
|

|
Álamo
Negro
|

|
Fuente:
(Prabir, 2010)
Tabla
3.
Poder
calorifico superior e inferior de cada Biomasa
Materia
prima
|
PCS
(KJ/Kmol)
|
PCS
(MJ/Kg)
|
PCI
(KJ/Kmol)
|
PCI
(MJ/Kg)
|
Bagazo
de cana
|
430877
|
17.85
|
404591
|
16.76
|
Cascara
de arroz
|
543796
|
16.03
|
503796
|
14.87
|
Eucalipto
Globulus
|
472838
|
19.22
|
443217
|
18.02
|
Secoya
gigante
|
480711
|
21.46
|
453829
|
20.26
|
Álamo
Negro
|
488756
|
20.03
|
457489
|
18.75
|
Fuente:
(Prabir, 2010)
Modelo de
gasificación
Para el
desarrollo del modelo, la fórmula química de la materia prima se
define como CHxOyNz
y
la reacción de gasificación se puede escribir de la siguiente
manera:
 (1)
(1)
Donde, x, y, z son los números
de átomos de hidrógeno, oxígeno y nitrógeno, por número de
átomos de carbono en la materia prima, respectivamente. En la
reacción química se considera biomasa sin humedad y m es la
cantidad de oxígeno por Kmol de materia prima. Donde
 pode ser calculado con:
pode ser calculado con:

Todos los reactivos de la
ecuación (1) se consideran 25 ℃. En el lado derecho de la ecuación
(1) tenemos los ni
que son los números de moles de cada especie i que se desconocen.
Modelo de
gasificación
Para encontrar
los coeficientes de las cinco especies que componen el gas producto,
se requieren cinco ecuaciones. Estas ecuaciones se generan utilizando
el balance de masa y las relaciones constantes de equilibrio.
Considerando la reacción de gasificación global en la ecuación
(1), las tres primeras ecuaciones se formulan para un elemento
químico como se muestra en las ecuaciones (2) - (4):
Balance
de carbono:
 (2)
(2)
Balance
de Hidrogênio:
 (3)
(3)
Balance
de Oxigênio:
 (4)
(4)
Termodinámica
de Equilíbrio
El equilibrio
químico generalmente se explica minimizando la energía libre de
Gibbs o usando la constante de equilibrio.
Para minimizar
la energía libre de Gibbs, utilizamos métodos de optimización con
restricciones que generalmente requieren una comprensión de teorías
matemáticas complejas. Mediante este flujo, el presente modelo de
equilibrio termodinámico se desarrolla basándose en la constante de
equilibrio y no en la energía libre de Gibbs. Las otras ecuaciones
se obtienen de las constantes de equilibrio de las reacciones que
ocurren en la zona de gasificación. Las principales reacciones que
ocurren en un gasificador Downdraft se muestran a continuación:
Reacción
de Boudouard: C+CO2→2CO
Reacción
Agua-gas: C+H2O→CO+H2
Las
reacciones que se muestran arriba se pueden mezclar en una reacción
simple conocida como reacción de cambio de vapor de agua.

Otra
reacción muy importante en el proceso de gasificación es la
formación de metano como se muestra a continuación:

Entonces,
la constante de equilibrio para las ecuaciones anteriores en función
de su composición molar se puede escribir de la siguiente manera:
 (5)
(5)
 (6)
(6)
Donde Ntotal
es el número total de moles gaseosos en el reactor gasificador.
Entonces las ecuaciones (5) y (6) se pueden modificar así:
 (7)
(7)
 (8)
(8)
Para
determinar el valor de K1
y K2
se utilizan las ecuaciones (9) y (10) para el estado de equilibrio de
una mezcla de gases ideales.
 (9)
(9)
 (10)
(10)
Donde
 es calculado empíricamente,
es calculado empíricamente,
 es la constante universal de los gases,
es la constante universal de los gases,
 ,
,
 es una función de Gibbs standard de reacción en
es una función de Gibbs standard de reacción en
 representa una función de Gibbs standard de formación a una
temperatura
representa una función de Gibbs standard de formación a una
temperatura
 para cada espécie
para cada espécie
 que puede ser expresado por la siguiente ecuación empírica:
que puede ser expresado por la siguiente ecuación empírica:
 (11)
(11)
Los valores de los coeficientes
a´-g' y la entalpia de formación de gases son presentados en la
tabla 4 . Se supone que el gas de síntesis es una mezcla de gases
ideales, por lo que se puede realizar la siguiente formulación:
 (12)
(12)
Donde
 y
y
 representa la diferencia de entalpia entre qualquer estado o estado
de referencia. Esto puede aproximarse mediante:
representa la diferencia de entalpia entre qualquer estado o estado
de referencia. Esto puede aproximarse mediante:

Donde
 es el calor específico a presión constante em
es el calor específico a presión constante em
 y está en función de la temperatura. Esto puede definirse por la
ecuación empírica:
y está en función de la temperatura. Esto puede definirse por la
ecuación empírica:
 (14)
(14)
Donde
 es la temperatura em Kelvin (
es la temperatura em Kelvin ( )
y:
)
y:

Donde
 es una constante obtenida de la integración de
es una constante obtenida de la integración de
 los coeficientes específicos de cada especie, que se muestran en la
tabla 5.
los coeficientes específicos de cada especie, que se muestran en la
tabla 5.
Ahora que tenemos una entalpía
de formación de combustible (gas de síntesis) la temperatura de la
llama adiabática se puede calcular considerando la combustión
completa, mediante la siguiente reacción:

Mediante un simple balance de
elementos C, H, O, N, podemos obtener los coeficientes
estequiométricos a, b, c. Finalmente utilizando la ecuación de
balance energético para un sistema abierto (cámara de combustión)
en los casos en los que hay reacciones químicas.

Dado que se considera que la
cámara de combustión está inmóvil y adiabática, la ecuación se
puede escribir de la siguiente manera:


Sustituyendo valores podemos
obtener la temperatura de llama adiabática. Con este resultado
podemos saber cuál de las biomasas utilizadas transformará la
energía térmica almacenada en mayor cantidad en energía
utilizable. Además, se puede mostrar la relación que existe entre
el PCI de biomasa y la temperatura de llama adiabática.
Tabla
4.
Valor
de
 y coeficientes de la ecuación empírica para
y coeficientes de la ecuación empírica para

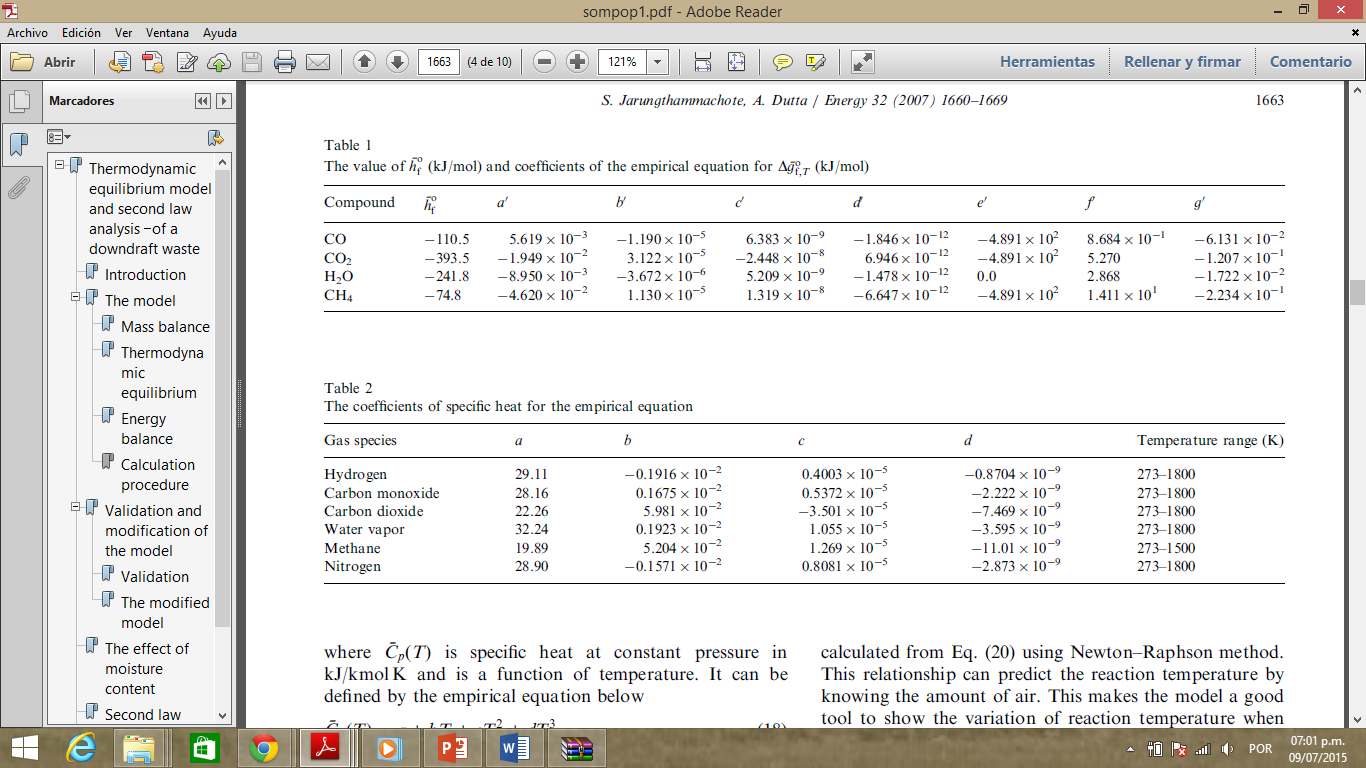
Fuente:
(Probstein & Hicks, 1982)
Tabla
5.
Coeficientes
de calor específico para la ecuación empírica

Fuente:
(Cengel, 2002)
Resultados
Se realizó una comparación de
las cantidades de moles de cada elemento que forma parte del gas de
síntesis. ( ,
, ,
, ),
utilizando el gráfico obtenido en el artículo de Jarungthammachote
(Jarungthammachote & Dutta, 2007).
),
utilizando el gráfico obtenido en el artículo de Jarungthammachote
(Jarungthammachote & Dutta, 2007).


Figura 1.
Comparación de la eficiencia de gasificación para cada biomasa.
Fuente:
(Jarungthammachote & Dutta, 2007)
En este caso las cantidades
obtenidas al analizar las fórmulas empíricas son:
 ,
,
 ,
,
 ,
,
 ,
,
 .
.
El modelo
termoquímico se aplica a los cinco tipos de biomasa como son: Bagazo
de Caña de Azúcar, Cascarilla de Arroz, Eucalyptus Globulus
(Eucalipto Azul), Secuoya Gigante, Álamo negro, al realizar el
cálculo para cada biomasa considerada, tenemos los siguientes
resultados:


Figura
2.
Comparación de eficiencia de gasificación para cada biomasa.
Fuente:
Elaboración propia
Podemos
observar que la mayor eficiencia de gasificación es para el bagazo
de caña de azúcar y la menor eficiencia de gasificación es para la
cascarilla de arroz con valores de 95.08% y 79.19% respectivamente.
Indica la capacidad del gasificador para intercambiar la energía
contenida en la materia prima (biomasa) en energía utilizable (gas
de síntesis).
El valor más
alto para el PCI del gas de síntesis para los cinco tipos diferentes
de materia prima es para la gasificación de la cáscara de arroz y
tiene un valor de 398969,12 KJ⁄Kmol.


Figura
3.
Comparación de poderes caloríficos inferiores para cada biomassa.
Fuente:
Elaboración propia
El gas de
síntesis, producido por cada biomasa, se utilizó en un proceso de
combustión completo o estequiométrico y se puede obtener la
temperatura de llama adiabática que indica cuál de las materias
primas tiene mayor energía térmica ya que se calcula con medidas de
temperatura.


Figura
4. Comparación de
temperaturas de llama adiabática para cada biomasa
Fuente:
Elaboración propia
Se realizó una comparación con
los resultados obtenidos en la simulación de la combustión del gas
de síntesis en la referencia de (Mendiburo, 2012)

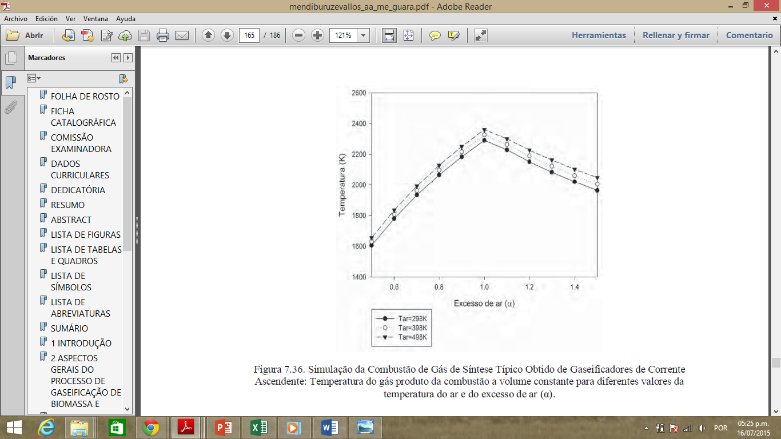
Figura 5.
Producto de temperatura del gas de combustión a volumen constante
para diferentes valores de temperatura del aire y exceso de aire.
Fuente:
(Mendiburo, 2012)
Como puede ver los resultados
obtenidos para una combustión completa
 de gas de sínteses de
los
cinco tipos de biomassa som cercamos a lós obtendo com ele modelo de
equilíbrio termoquímico realizado en este trabajo.
de gas de sínteses de
los
cinco tipos de biomassa som cercamos a lós obtendo com ele modelo de
equilíbrio termoquímico realizado en este trabajo.
Conclusiones
El
modelo de equilibrio termodinámico fue desarrollado para el
gasificador Downdraft con el propósito de calcular la composición
del gas producido, también se puede calcular la eficiencia de
gasificación para cada materia prima: bagazo de caña de azúcar,
cascarilla de arroz, eucalipto globulus, secuoya gigante, álamo
negro.
El aire se utiliza para oxidar
(proceso de combustión) el gas producido por la materia prima (gas
de síntesis) a los cinco tipos de materia prima.
La fórmula empírica y los
valores caloríficos se calcularon utilizando el resultado del
último análisis (análisis final) de cada materia prima.
Para encontrar la composición
del gas producto, se utilizaron cinco ecuaciones, tres de las cuales
representan ecuaciones de equilibrio elementales y las otras dos son
ecuaciones de constante de equilibrio.
Para el tipo de gasificador
elegido (Downdraft), se asumió una temperatura de 800 ℃ para el
gas de síntesis.
Por las suposiciones hechas al
inicio se encontró que la mayor energía térmica es para la
secuoya gigante con un valor de 2253.34 K por otro lado, la cáscara
de arroz utilizada como materia prima es la que tiene el mayor valor
de PCI para el gas de síntesis.
Referencias
Abuadala, A.,
I, D., & G, N. (2010). Exergy analysis of hydrogen production
from biomass gasification. International
Journal of Hydrogen Energy,
4981-4990.
Altafini, C.,
Wander, P & Barreto R. Prediction of the working parameters of a
wood waste gasifier through an equilibrium model. Energy Convers
Manage 2003; 44: p.2763-77.
Bacon, D.,
Downie, J., Hsu, J & Peters, J. Modeling of fluidized bed wood.
Gasifiers. In: Overend RP, Milne TA, Mudge KL, editors.
Fundamentals of thermochemical biomass conversion. UK: Elsevier
Applied Science Publishers; 1982.p.717-32.
Cengel, Y. B.
(2002). Thermodynamics
an engineering approach. .
New York: McGraw-Hill.
Chen, W., &
Jiang, T. (2008). An experimental study on carbon monoxide
conversion and hydrogen generation from water gas shift reaction.
Energy
Conversion and Management,
2801-2808
.
Gasification
Word Database 2007 (Current Industry Status Report). (2007). Office
of Fossil Energy Technology Laboratory.
Green, D.,
Perry´s chemical engineers handbook. 1984: McGraw Hill New York.
Higman, C. &
Van Der Burgt, M. Gasification. 2003: Gulf Professional Publishing.
Higman, C., van der Burgt, M.,
2008. Gasification,
2nd ed. Gulf Professional Publishing/Elsevier.
IFP–Innovation
Energy Environment, 2007. Potential biomass mobilization for biofuel
production worldwide, in Europe and in France, Panaroma, www.ifp.fr.
J.A.Carvalho,
M.Q. McQuay, Princípios de Combustão Aplicada (Principles of
Applied Combustion), UFSCP Ed. São Paulo – Brasil, 2007 (In
portuguese)
Jarungthammachote,
s., & Dutta, A. (2007). Thermodynamic Equilibrium model and
second law analysis of a Downdraft waste gasifier. Energy,
1660-1669.
Jarungthammachote,
S., & Dutta, A. (2007). Thermodynamics equilibrium model and
second law analysis of a downdraft waste gasifier. . Energy,
1660-1669.
Li, X., Grace
JR., Watkinson., AP, Lim CJ., Ergudenter, A. Equilibrium modeling of
gasification: a free energy minimization approach and its
application to a circulating fluidized bed coal gasifier. Fuel 2001;
80: p.195-207.
Mendiburo, A.
(2012). Simulação
da produção e combustão de gás de síntese oriundo de
gaseificadores de leito fixo.
Morris, M., &
Waldheim, L. (1998). Energy
recovery from solid waste fuels using advanced gasification
technology.
Waste Manage.
Mountouris,
A., Voutsas, E. & Tassios, D. Solid waste plasma gasification:
Equilibrium model development and exergy analysis. Energy conversion
and Management, 2006. 47 (13-14): p. 1723-1737.
Nakamura, A.,
Kiyonaga, E., Yamamura, Y., Shimizu, Y., Minowa, T., Noda, Y., &
Matsumura, Y. (2008). Gasification of catalyst-suspended chicken
manure in supercritical water. Journal
of Chemical Engineering of Japan,
433-440.
Pathak, B.,
Patel, S., Bhave, A., Bhoi, P., Sharma, A., & Shah, N. (2008).
Performance evaluation of and agricultural residue-based modular
throat-type downdraft gasifier for thermal application. Biomass
and energy,
72-77.
Prabir, B.
(2010). Biomass,
Gasification and Pyrolysis: Practical, design and Theory .
Probstein
R., Hicks R. Synthetic fuel. New York: McGraw-Hill; 1982.
Rezaiyan, J.
& Cheremisinoff, N , Gasification technologies: A primer for
engineers and scientist. 2005: CRC.
Ruggiero, M.
& Manfrida G. An equilibrium model for biomass gasification
process. Renew Energy 1999; 16: p.1106-9.
Sharma, A.
(2010). Modeling and simulation of a downdraft biomass gasifier 1.
Model development and validation. Energy
Conversion and Management.
Stephen, R.,
Turns. An introduction to combustion: concepts and applications.
Mechanical Engineering Series. McGraw Hill, 2000.
Tchobanoglous,
G., & Kreith, F. (2002). Handbook
of solid waste management.
New York: McGraw-Hill.
Tol, R. The
marginal damage costs of carbon dioxide emissions: an assessment of
the uncertainties. Energy policy, 2005. 33 (16): p. 2064-2074.
Walawender,
W., Hoveland, D., & Fan, L. (1985). Steam gasification of pure
cellulose. 1. Uniform temperature profile. Industrial
and Engineering Chemistry Process Design and Development,
813-817.
WENDER, I.
Reactions of synthesis gas. Fuel
Processing Technology,
vol. 48, p. 189-297, 1996
Xiang, W;
Wang, S & Di, T, Investigation of gasification chemical looping
combustion combined cycle performance. Energy and
Fuels, 2008. 22(2): p. 961-966.
Zainal, Z.,
Ali, R., Lean, C., & Seetharamu, K. (2001). Prediction of
performance of a downdraft gasifier using equilibrium modeling for
different biomass materials. . Energy
conversion and Management,
1499-1515.












 (1)
(1) pode ser calculado con:
pode ser calculado con:





 (5)
(5) (6)
(6) (7)
(7) (8)
(8) (9)
(9) (10)
(10) es calculado empíricamente,
es calculado empíricamente,
 es la constante universal de los gases,
es la constante universal de los gases,
 ,
,
 es una función de Gibbs standard de reacción en
es una función de Gibbs standard de reacción en
 para cada espécie
para cada espécie
 que puede ser expresado por la siguiente ecuación empírica:
que puede ser expresado por la siguiente ecuación empírica: (11)
(11) (12)
(12) y
y
 representa la diferencia de entalpia entre qualquer estado o estado
de referencia. Esto puede aproximarse mediante:
representa la diferencia de entalpia entre qualquer estado o estado
de referencia. Esto puede aproximarse mediante:

 es el calor específico a presión constante em
es el calor específico a presión constante em
 y está en función de la temperatura. Esto puede definirse por la
ecuación empírica:
y está en función de la temperatura. Esto puede definirse por la
ecuación empírica: (14)
(14) )
y:
)
y:
 es una constante obtenida de la integración de
es una constante obtenida de la integración de
 los coeficientes específicos de cada especie, que se muestran en la
tabla 5.
los coeficientes específicos de cada especie, que se muestran en la
tabla 5.



 y coeficientes de la ecuación empírica para
y coeficientes de la ecuación empírica para


 ,
, ,
, ),
utilizando el gráfico obtenido en el artículo de Jarungthammachote
),
utilizando el gráfico obtenido en el artículo de Jarungthammachote















